病毒性肝炎
现在位置:首页>>疾病百科>>病毒性肝炎
病毒性肝炎(viral heptitis)是由多种肝炎病毒引起的常见传染病,具有传染性强、传播途径复杂、流行面广泛,发病率较高等特点。临床上主要表现为乏力、食欲减退、恶心、呕吐、肝肿大及肝功能损害,部分病人可有黄疸和发热。有些患者出现荨麻疹、关节痛或上呼吸道症状。病毒性肝炎分甲型、乙型、丙型、丁型和戊型肝炎五种。以往所谓的非甲非乙型肝炎(NANBH)经血行感染者称输血后非甲非乙型肝炎(PT-NANBH),通过粪-口感染的称为肠道传播的非甲非乙型肝炎(ET-NANBH),近年来经分子生物学技术研究,证实上述非甲非乙型肝炎的病原引起病毒性肝炎者有二种类型,前者称丙型肝炎(hepatitis C;HC),后者称戊型肝炎(hepatitis E;HE)。急性肝炎病人大多在6个月内恢复,乙型、丙型和丁型肝炎易变为慢性,少数可发展为肝硬化,极少数呈重症经过。慢性乙型,丙型肝炎与原发性肝细胞癌的发生有密切关系。
【诊断】
各型病毒性肝炎的确诊主要藉抗原、抗体测定。肝炎的诊断还必须依据流行病学资料、症状、体征和实验室检查等加以综合分析而确定,必要时可作肝穿刺病理检查。
【治疗措施】
一般采取综合疗法,绝大多数肝炎病人都可恢复健康。治疗原则以适当休息、合理营养为主,适当辅以药物,避免饮酒、过度劳累和使用对肝脏有损害的药物。各型肝炎治疗方法如下。
(一)急性肝炎 病毒性肝炎为一种自限性疾病,若能早期诊断,采取适当休息、营养和一般支持疗法,多数病人在3~6个月内能自愈。对临床症状重笃或黄疸深重的急性肝炎患者,宜静脉给予高渗葡萄糖液、维生素C、肝泰乐、门冬氨酸钾镁等药物或加用清热利湿(茵陈蒿汤加减)的中药治疗。对急性黄疸型肝炎(乙型)不宜用肾上腺皮质激素(简称激素)治疗,一组1805例急性肝炎患者中911例应用激素治疗,余894例仅用维生素等一般药物治疗作为对照,经18~24个月随访,发现激素治疗组患者病情反复及演变为慢性肝炎者较对照组为多。甲型肝炎病人很少演变为慢性,故如有深度黄疸(肝内胆汗淤积),经其他疗法无效时,仍可考虑用激素治疗。1989我院收治的648例甲型肝中,有12例深度黄疸患者,其中7例应用激素治疗,疗效明显。激素以选用琥珀酰氢可的松或强的松龙为宜,前者剂量为200~300mg加于10%葡萄糖液500ml中静脉滴注,每隔7~10天根据肝功能改善情况可逐渐减量。后者剂量为30~40mg/d,以后逐渐减量,5~10mg/d为维持量,总疗程2~3个月;上述患者,经1年随访均告痊愈,病程中未见病情反复。
(二)慢性肝炎 慢性病毒性肝炎目前尚缺少物效治疗方法,鉴于病毒性肝炎的发病原理可能与病毒株的毒力、受感染肝细胞的数量和患者免疫系统的效应等因素有一定关系,故应用抗病毒药物、调整机体免疫功能及改善肝细胞功能的药物治疗,可能起一定作用。
1.抗病毒药物 对乙型肝炎病毒有抑制作用的药物有干扰素(interferon、IFN)、阿糖腺苷(Ara-A、vidarabine)、一磷酸阿糖腺苷(Ara-AMP)、阿昔洛韦(无环鸟苷acyclovir)、磷甲酸钠(foscarnet)、叠氮脱氧胸腺嘧啶核苷(AET)、右旋儿茶素(cyanidanol-3)、利已韦林(三氮唑核苷、ribavirin)及干扰素诱导剂——聚胞嘧啶核苷酸(简称聚肌胞,即polyl:C)等。其中以干扰素和阿糖腺苷、干扰素和无环鸟苷联合应用,激素与重组α干扰素先后使用对消除HBV复制标志较为有效。
干扰素(IFN)有α-IFN、β-IFN和γ-IFN三种,分别由人体白细胞、纤维母细胞及致敏淋巴细胞所产生,以α-干扰素作用最强。其作用机理在于阻断病毒繁殖和复制,但不能进入宿主细胞直接杀灭病毒,而是与细胞膜接触并在细胞内产生一种特殊蛋白质即抗病毒蛋白(AVP),后者可抑制病毒mRNA信息的传递,从而阻止病毒在宿主细胞内繁殖。干扰素在病毒感染的细胞中还能诱导蛋白激酶及2'5'寡腺苷合成酶(2'5'AS)的产生,然后2'5'AS激活一个内源性核酸内切酶降解病毒RNA,同时蛋白激酶能灭活核糖体合成2所必需的酶,从而使蛋白合成减少,病毒生长受到阻抑。干扰素对B细胞的功能,在一定条件下起抑制或增进作用,如干扰素浓度高时有明显抑制抗体反应,临床应用大剂量IFN-α治疗慢性病毒性肝炎,可使血清IgG、IgM异常升高者得到改善或恢复,其作用亦系干扰素抑制B细胞的作用,使浆细胞制造免疫球蛋白抗体过多现象得到缓解所致。干扰素对效应细胞的作用,它可以增加组织相容抗原-Ⅰ(HLA-1)的表达,这些抗原对杀伤性T细胞识别靶细胞是十分重要。此外还证实γ-干扰素有增加白细胞介素-2(IL-2)受体作用,而IL-2又可增加有丝分裂刺激淋巴细胞诱生γ-IFN,故IL-2与γ-IFN在功能上有密切联系和协调作用。
应用干扰素治疗慢性乙型肝炎目的是清除体内HBV-DNA及HBeAg,并诱导血清中HBeAg转化为抗-HBe,肝细胞核内HBcAg使其消失,肝脏组织学病变改善及ALT恢复正常。干扰素治疗慢性乙肝的疗效从30%~60%不等。通过近几年来作者应用干扰素的经验,选择以下情况的慢性乙肝病人应用干扰素治疗有较好的治疗反应:即①治疗前血清ALT或AST有反复波动或酶的活力有持续升高者;②治疗前血清HBeAg的P/N值异常而偏低(P/N5-8)或HBV-DNA水平低(<100pg/ml)者;③有明确急性发病史,病情较短者;④应用干扰素剂量宜大(300万~600万单位,隔日皮下或肌肉注射1次,即3~6Mu/隔日,疗程宜长,一般6~12个月为一疗程;⑤肝脏病理有活动性炎症病变9如有碎屑样坏死)者疗效佳;⑥无重叠感染者(如丙型肝炎、丁型肝炎等);⑦无HIV感染或免疫抑制治疗者;⑧肝组织内含铁量低者;⑨治疗期间血清中无干扰素中和抗体产生者;⑩女性患者疗效比男性为佳。本院自1988~1993年应用γ-干扰素治疗43例慢性乙型肝炎,干扰素用量3Mu/d×2周,继之3Mu/qod×14周,共治10例,干扰素用量为1M~1.5Mu/d×16周,共治15例,0.25Mu~0.5Mu/d×16周,共治10例,用量0.015Mu~0.03Mu/d×16周,共治8例,均为肌肉注射,结果:3Mu组的10例中有5例(50%)HBeAg阴转,1Mu×1.5Mu组的15例慢性乙肝中有4例(26.6%)HBeAg阴转,而应用小剂量(<0.5Mu)干扰素的18例无1例HBVM阴转。本院又于1990年起用α 1b基因工程干扰素(国产,现名赛若金)治疗20例慢性乙型活动性肝炎(CAHB)患者,剂量为4Mu/d(16例、6Mu/d及2Mu/d各2例,2个月为一疗程。结果HBeAg的阴转率为55.0%(11/20),11例HBeAg阴转患者中,同时抗-HBe阳转者为6例(54.5%)。对照组14例CAHB患的血清HBeAg及抗-HBe治后均无变化。
干扰素对慢性乙肝的疗效较已肯定,近期Marracher综合文献应用α2b干扰治疗440例慢性乙肝的结果,治疗HBeAg、HBV-DNA及HBsAg的阴性率分别为51%~66.49%、49%~72%及2.5%,抗HBe阳性率为44%~62%。治疗3~6月,肝组织学改善占24%~60%。
α-干扰素对慢性丙型肝炎的治疗,综合18篇有关文献表明,在不同剂量和用药时间长短以及病情或病毒基因的差异与干扰素的疗效有很大区别。在丙型肝炎中,大多数早期的研究均以肝功能ALT、AST水平的变化判定治疗的效果。对α-干扰素治疗有反应的病人,常表现治程中ALT、AST活力有明显下降,能完全复常者可达50%以上。但当停药后ALT又异常者亦有50%。从大多数临床资料观察α-干扰素应用剂量在3Mu以上,疗程在6~12个月的一些病人ALT持续在正常范围者占多数,若测定血清HCV-RNA由阳性转为阴性者,则能确定临床基本治愈。HCV-RNA定量测定是预测α-干扰素治疗疗效,调整剂量及决定疗程的可靠指标。与α-干扰素治疗疗效有关因素有以下几方面:①病程短,早期用α-干扰素治疗者;②HCV-RNA水平低者;③应用α-干扰素剂量大(4.5Mu~6Mu或10Mu/d~qod)治疗疗程>6个月,长者可达1年或更长;④HCV基因Ⅲ的病人;⑤用药后ALT在2个月后能持续正常者的慢性丙肝病人往往能取得良好的疗效。
阿昔洛韦(无环鸟苷)在细胞内能转变为具有抗病毒活性的三磷酸无环鸟苷,后者具有抑制病毒DNA多聚酶和中止病毒DNA链延伸的作用。无环鸟苷对病毒DNA多聚酶的抑制作用,比对宿主细胞DNA多聚酶的抑制作用强10~30倍,约3000倍的抑制病毒增殖浓度才能抵制宿主细胞的生长,故其对机体毒性极低。阿糖腺苷对慢性乙型肝炎(慢乙肝)患者清除HBV复制标志的效果约20%(16/80),无环鸟苷对抑制血清HBV有效率约26.6%(4/15);而以上药物分别与干扰素联合治疗时可提高疗效。1981年Scullard等对16例慢性乙型肝炎(慢乙肝)患者使用IFN Ara-A联合疗法,治后HBeAg转阳者43.7%(7/16)。1987年Man等采用IFN与脱氧无环鸟苷联合治疗18例慢乙肝患者,治后HBeAg转阴者38.9%(7/18)。此外,激素与抗病毒药先后应用,对慢乙肝患者HBeAg转阴等有较好作用。Yokosuka等对29例HBeAg阳性的慢性肝炎患者分3组治疗,第1组9例先用强的松龙,每日40mg,连用4周,隔1~2周继用Ara-A,剂量为每日5~10mg/kg静注,持续4~8周。治后HBeAg转阴者6例(67%),DNA多聚酶活性消失者7例(78%)。第2组10例单用阿糖腺苷,剂量为每日5~10mg/kg,4~8周为1疗程,治疗后HBeAg转阴者1例(10%)、DNA多聚酶活力消失者6例(60%)。第3组10例为对照(未用激素或Ara-A),HBeAg转阴者2例(20%),DNA多聚酶活性消失者2例(20%)。近年来文献报道激素与重组α干扰素(基因工程制备的干扰素)先后治疗慢乙肝患者能提高疗效。1988年韩国召开亚太地区干扰素会议,综合日本、香港、台湾报道215例慢乙肝患者中,应用激素与重组α-2b干扰素9INTRON-A)先后投药的疗效,结果HBeAg阴转率为76.0%、HBV-DNA阴转率80%,抗-HBe阳转率24.6%,ALT恢复正常82.3%。1989年我院等应用激素与INTRON-A先后疗法,治疗9例慢乙肝患者,结果HBeAg转阴为7/9例,同时抗-HBe阳转为5/9例。药物使用方法为:先予强的松龙治疗4周(40mg/d×14天,继以20mg/d×14天),然后撤除强的松龙,间歇1周后再予INTRON-A治疗。剂量为2.5×10 6~5×106IU,每日肌注1次,连续2周,第3周开始,同一剂量1周3次,共14周。药物副作用有发热、全身酸痛、白细胞减低等,停药后即消失。
干扰素诱导剂-聚肌胞对清除HBeAg和降低DNA多聚酶活性似有一定疗效。本品与Ara-A联合治疗慢乙肝患者可巩固疗效,我院曾报道应用Ara-A4周疗法之后,给予聚肌胞,隔日肌注4mg,连续3个月,与对照组相比,HBeAg、HBV-DNA和DNA多聚酶阴转率有明显差异。
2.免疫调节剂
⑴免疫抑制疗法:常用药物有肾上腺皮质激素(强的松、强的松龙、地塞米松、琥珀酰氢可的松等)、强力新、秋水仙碱、硫唑嘌噙等。激素治疗病毒性肝炎的新概念是抑制迟发型免疫反应,可使胸腺萎缩、破坏,从而减少淋巴细胞的生成。激素可增加肝糖原,促使肌肉和骨骼的蛋白质分解,相反,在肝内可促使肝细胞合成蛋白质。文献报道小剂量激素能促进机体巨噬细胞吞噬作用,中、大剂量激素有抑制细胞的吞噬功能,故病人长期使用激素易发生继发感染。激素有保护肝细胞的溶本科体膜和线粒体的作用,并能促进毛细胆管内胆汗的排泄,故而有退黄利胆作用。但本品有抑制抗体产生,招致形成肝炎病毒携带状态的可能,故应严格掌握适应证。慢性活动性肝炎(慢活肝)应用激素的指征为:①病情反复波动,伴有肝外自身免疫状态的症状和体征,如慢性多发性关节炎、慢性肾小球肾炎、慢性溃疡性结肠炎、桥本氏甲状腺炎、脉管炎、皮肌炎等;②肝功能异常,如血清球蛋白明显增高、A/G倒置、转氨酶反复异常,且AST∶ALT>0.5∶1,并伴黄疸经其他治疗无效者;③免疫球蛋白明显增高、类风湿因子(RF)和自身抗体(如平滑肌抗体、抗核抗体、抗线粒体抗体、抗甲状腺抗体、抗肾抗体、抗胆管抗体、抗枯否氏细胞抗体、抗心肌抗体、抗-LSP和抗-LMA等)持续阳性者;④HBV标志以阴性为宜;⑤无激素治疗禁忌证(如高血压、糖尿病、溃疡病、高脂血症等)者;⑥慢性淤胆型肝炎等。采用激素治疗慢性活动性肝炎各学者意见尚未完全一致,宜根据口才的临床特点、实验室检查以及病理与免疫学指标等作出决定。若能严格掌握指征,则可能取得一定效果。
强力新(Minophagen-C)为一种类皮质激素的新制剂,主要成分为甘草酸。日本龄木宏等应用本品治疗慢性肝炎67例,临床疗效达68.6%(46/67),对照组66例中仅17例有效(25.7%)。国内汪俊韬等应用强力新治疗25例慢性肝炎,同期内以安慰剂治疗23例慢活肝,并以双盲法对照,证实强力新组在用药后2~4周时的降酶(ALT)作用显著优于对照组,但最终疗效与对照组相比,无显著差异。本院曾用国产强力新(强力宁)注射液并以双盲对照法治疗慢性肝炎34例,证实本药对慢性肝炎的临床疗效为82.4%(28/34),对肝功能ALT及AST异常者降酶有效率分别为82.4%及62.9%。吴唯一等报道用强力宁治疗104例慢性肝炎,显效53例,有效38例,无效13例,总有慢性肝炎,显效53例,有效38例,无效13例,总有效率87.5%,降酶(ALT)效果取决于强力宁剂量,常用剂量为160~240mg加于10%葡萄糖250~500ml静脉滴注,每日1次,1~2个月为一疗程。在鼠的动物实验中,强力新能诱导动物体内干扰素的产生。熊田博光等报道8例HBeAg阳性慢活肝患者,用强力新治疗后有6例转阴,其中3例产生e抗体。本院对10例慢活肝应用强力新治疗前后分别测定患者血清中干扰素滴度,结果未证实本品有诱导病人体内产生干扰素的作用。文献报道强力新除有类激素作用外,并可降低胆固醇、抗过敏和阻止抗原抗体复合物的形成。有关强力新治疗慢性肝炎的作用机理目前尚未十分清楚,其远期疗效亦有待进一步观察。
秋水仙碱(colchicine)为治疗痛风药物,近年来少数学者用以治疗慢活肝和肝硬化,获得一定疗效。1973年Kojkind等指出本品具有抑制肝脏纤维化的作用。Shek等证实秋水仙碱能杀伤抑制性T细胞(Ts),从而消除Ts对抗体形成的抑制作用。周明行等报道,应用秋水仙碱治疗12例慢活肝患者,治后显效,有效者分别为5例和3例,有效率为66.7%(8/12)。动物实验证实,秋水仙碱对中毒性肝炎小鼠的肝细胞病变有修复作用。临床治疗剂量为每次0.5mg,每日服2次,3个月为一疗程。本品的副作用为可使白细胞及血小板减少。
⑵免疫促进剂:慢性乙型肝炎患者细胞免疫功能大多低下,致使肝炎病毒在体内持续存在,通过免疫反应产生肝细胞坏死。如能使机体细胞免疫功能恢复,病毒有可能得以清除,从而使疾病恢复。试用的药物有免疫核糖核酸、胸腺肽、猪苓多糖、香菇菌多糖、云芝胞内多糖及白细胞介素-Ⅱ等。免疫核糖核酸系从HBsAg免疫的动物脾及淋巴结提取而得,具有免疫生物活性。文献报道18例慢性乙型肝炎患者,经本品治疗后,有7例HBeAg转阴,而对照组15例中,仅1例HBeAg转阴。本院用免疫核糖核酸治疗9例慢活肝患者,结果4例HBeAg转阴,其中2例产生e抗体。用法:每周2次,每次皮下注射2ml,两个月为一疗程。用药期间未见不良反应。胸腺肽在体外能促进T细胞的成熟分化,系从牛或猪胸腺中提取的血清胸腺因子,临床治疗慢性乙型肝炎患者似有免疫增强作用。用法:每周2次,每次肌注4mg,2~3个月为一疗程。治程中少数患者转氨酶可暂时上升,但不影响治疗。猪苓多糖为中药猪苓中提取的有效成分,实验证明有减轻肝损伤及促进肝脏再生的作用。文献报道150例慢性乙型肝炎中,用药后有60例HBeAg转阴,而对照组36例中仅1例HBeAg转阴。用法:每日1次,每次20~40mg作深部肌注,连续20天,休息10天,3个月为一疗程。应用本品无明显副作用。香菇菌多糖是从香菇菌深层培养的菌丝体和发酵液中得到的多糖体,国内几家医院临床试用,对慢性乙型肝炎的有效率为52.8%,比对照组36.8%略佳。但HBV标志转阴率仅17%。用法:每日2次,每次口服5片(每片含2mg),2~3个月为一疗程。云芝胞内多糖为杂色云芝菌发酵菌丝提出的一种葡聚糖,在动物体内可诱生干扰素,能促进吞噬功能,对实验性四氯化碳引起的肝损害有保护作用。穆国尧等报道用云芝胞内多糖治疗慢性乙型肝炎47例,HBsAg转阴或滴度下降者12例,病人非特异性免疫功能有所增加。用法:每日3次,每次口服1克,连续3个月。白细胞介素-Ⅱ(IL-Ⅱ)治疗慢性乙型肝炎国外已有报道,在乙型慢活肝时,T淋巴细胞产生白细胞介素-Ⅱ低下,以外源性基因重组的IL-Ⅱ治疗,可使HBV复制标志转阴,DNA多聚酶活力亦降低,国内亦已在试用中。对慢性乙型肝炎的治疗剂量为每周2次,每次1000单位,2~3个月为一疗程。
3.改善肝细胞功能的药物 慢性肝炎患者可适量补充多种维生素(复合维生素B、B1、C、K等),以促进消化功能、提高食欲,对促进肝细胞的修复有一定作用。1、6-二磷酸果糖(FDP)为高能量细胞促进剂,它与肝细胞膜表面接触后,产生二磷酸果糖激酶,后者能促进细胞内ATP合成增加,使细胞的钠泵作用加强,有利于细胞内外钾、钠离子的交换,从而使肝细胞混浊肿胀、水肿样病变得以修复,肝细胞功能亦随之恢复。用法:每日1次,每次5~10克加于5%葡萄糖液或缓冲液100ml内静脉滴注,2周为一疗程。本品适用或缓冲液100ml内静脉滴注,2周为一疗程。本品适用于病情较重的慢活肝伴有黄疸的病人。阿卡明(aicamin)可改善肝脏的蛋白、脂肪和糖代谢,对降低转氨酶亦有一定作用,剂量为每日3次,每次口服0.1~0.2g,2~3个月为一疗程。
中草药及其制剂对改善肝细胞功能及临床症状均有一定作用。常用者有五味子单体合成剂——联苯双脂、垂盆草、鸡骨草、葫芦素片、水飞蓟(益肝灵)、齐墩果酸片、甘草甜素片、黄芩甙、茵栀黄、青叶胆、螃蜞菊、肝炎灵(山豆根)、苦参片、黄芪、丹参、护肝片等,其中以联苯双脂、精制垂盆草、肝炎灵等降酶效果最明显,但停药后部分病人的酶值又复升高,以上药物的作用机理尚在深入研究中。
(三)重症肝炎的治疗 急性重症肝炎病死率高,目前尚无满意的特殊治疗,故采取综合性治疗措施很有必要。
1.一般治疗 患者应绝对卧床休息,防止交叉及继发感染,对意识障碍病人应注意皮肤、口腔护理,避免褥疮及呼吸道感染,病室内定时作紫外线消毒,工作人员严格执行隔离消毒制度,对长期静脉输液及保留导尿管者应防止继发感染。饮食以清淡低脂流质为主,对昏迷病人应予鼻饲,每次鼻饲前应抽胃内容物,注意有无出血。有肝昏迷前期症状者不能食高蛋白饮食。有腹水患者宜记24小时液体出入量,补液量应适当限制。注意预防继发感染,可注射丙种球蛋白,每次3ml肌注,每周1次,或口服卡那霉素1.0g,每日2次,以控制肠道细菌的生长。
2.抗病毒药物应用 1986年Price等报道1例乙型肝炎及δ病毒混合感染所致急性重症肝炎(暴发型肝炎)患者,使用磷甲酸钠治疗,取得满意疗效,治疗后第3天病人清醒(治前深度昏迷),最后HBV标志亦转阴。1987年Hedin综述使用磷甲酸盐治疗乙型肝炎或丁型肝炎混合感染的8例暴发型肝炎,其中6例存活。磷甲酸钠总量达30g。国内磷甲酸钠已试制成功,不久将可供临床使用。
3.免疫调节剂的应用
⑴肾上腺皮质激素(激素)治疗:国外学者对近20年来应用激素治疗重症肝炎的结果作回顾性评价,认为激素对病毒性肝炎肯定无效。但从国内资料看来,对早期患者免疫学检查证明有较强免疫(包括细胞和体液免疫)反应者,用激素治疗仍可获得一定疗效。可选用琥珀酰氢化可的松300~500mg加工10%葡萄糖500ml中,静脉滴注,每日1次,5~7天为一疗程。
⑵胸腺肽治疗:国内报道胸腺肽与其他综合疗法对50例亚急性重症肝炎患者的治疗结果:治疗组病死率28%(14/50),对照组病死率75%(39/52)。治疗组昏迷者23例,10例存活,而对照组昏迷者21例,3例存活,两组比较,有非常显著差异。胸腺肽剂量为20mg加于10%葡萄糖250ml静脉滴注,每日1次,待病情好转逐渐减为隔日1次至每周1次。采用胸腺肽等综合疗法,可使病死率降至28%,但上述病例平均每例应用血浆2900ml,白蛋白28%,但上述病例平均每例应用血浆2900ml,白蛋白160g,难以推广普及。
⑶强力宁:本口有类似肾上腺皮质激素作用,临床已应用于重症肝炎的治疗方法为强力宁160~240mg加于10%葡萄糖500ml中静脉滴注,每日1次,待病情好转逐渐减量至80~120mg/日。以强力宁与激素对比观察各治疗20例慢性重症肝炎,结果表明,采用激素治疗组的继发感染率明显高于强力宁治疗组,(10/20与1/20之比)P<0.01。而临床症状与肝功能的改善、复发率及病死率等两组无差别。
4.活跃微循环的药物治疗 文献报道莨菪类药物和小剂量肝素、丹参等,有改善微循环的作用。朱家骐等报道58例重症肝炎(急性33例)、亚急性25例)用包括莨菪碱类药等的综合疗法,结果死亡27例,病死率为46.55%,对照组61例中,死亡40例,病死率为65.47%,两组相比有显著差异。缪正秋报道12个单位647例重症肝炎以莨菪类药为主进行治疗,并与360例对照组进行疗效比较,结果表明,在综合治疗基础上加用莨菪类药能明显提高重症肝炎的存活率,还发现莨菪组患者尿量明显增多,能显著减少肝肾综合征的发生。本院应用东莨菪碱治疗重症肝炎,经甲皱微循环镜检查,发现重症患者常有毛细血管攀细长或扭曲,伴微血管痉挛及渗血现象,经东莨菪碱治疗后微血管痉挛改善、红细胞流速增快。东莨菪碱剂量为0.6~1.2mg加入10%葡萄糖液中静脉滴注,每日1次。
5.肝昏迷的治疗 由血氨增高引起肝昏迷者应用谷氨酸类、乙酰谷酰胺等有一定疗效,乙酰谷酰胺通过血脑屏障,分解为谷氨酸及γ-氨基正丁酸,有降低脑内氨的作用。由胺类物质(如苯乙醇胺、苯丙氨酸、β-羟酪胺等)代谢障碍引起神经系统症状者可用左旋多巴治疗,左旋多巴能与上述胺类物质相拮抗而解除神经传递的障碍,使正常功能恢复。左旋多巴剂量为每次100~150mg,加于10%葡萄糖液500ml中静脉滴注,每日1~2次。应用本品时可发生短暂高血压现象,故有脑水肿者不宜应用。重症肝炎肝昏迷时常有支链氨基酸与芳香氨基酸比例失调,可从正常时的3~3.5下降至2以下。应用支链氨基酸治疗重症肝炎肝昏迷可获一定效果。此外,应用血液交换、体外肝灌流、吸附剂灌流及血液透析或滤过等治疗重症肝炎肝昏迷,能暂时使患者意识清醒,但不能提高病毒性肝炎存活率。胰高糖素-胰岛素疗法可促进氨基酸透过细胞膜及促进蛋白分解,有助于改变和维持支/芳比值,改善肝性脑病。剂量为每日胰高糖素1~2mg、正规胰岛素6~12u,加于10%葡萄糖500ml中静脉滴注,2~3周为一疗程。疗程中常见副作用有恶心、呕吐等。
6.其他 重症肝炎患者常并发出血、感染、脑水肿、肾功能衰竭和电解质紊乱等,必须加以及时处理。由肝细胞合成凝血因子减少所致的出血可用凝血酶原复合物400u加入5%葡萄糖250ml静脉滴注,每周3~4次,并用维生素K 120~30mg肌注或稀释后静滴,每日1次。对有继发细菌感染者,如胆道、腹腔、泌尿道、肠道、肺部感染等,可根据感染部位,致病菌种类以及有无肾功能损害等选用β-内酰胺类(青霉素类或头孢菌素类)以及氨基糖甙类(庆大霉素、丁胺卡那霉素等)抗生素。肝昏迷伴脑水肿、脑疝的治疗,可给20%甘露醇250ml于30分钟内快速静滴,亦可加用利尿剂。肝肾综合征可给多巴胺扩张肾动脉,也可用较大剂量利尿剂(速尿、丁胺脲等),同时禁用对肾有损害的药物。
【病原学】
甲型肝炎病毒(HAV)是一种微小核糖核酸(RNA)病毒,其形态为无囊膜的20面体呈立体对称的球形颗粒,直径25~29nm,内含单股正链RNA基因组,沉降系数33~35S,分子量2.25×10 6~2.8×106,病毒基因组已被克隆和核酸序列分析,仅有一个血清型和一个抗原体系统。HAV在体外抵抗力较强,能耐受50℃60分钟及pH 3的酸性环境,但在100℃5分钟、氯1mg/L30分钟、紫外线照射1小时,甲醛1∶400037℃72小时均可灭活。HAV在体外培养已获得成功,可在原代狨猴肝细胞、猴胚肾细胞、人肝癌细胞、人胚二培体或纤维细胞、羊膜细胞等多种细胞中生长繁殖。细胞培养的HAV一般无细胞致病作用,但在人肝癌细胞中培养所得的HAV,可能有致癌基因作用,不能作为甲肝抗原疫苗的制备。HAV经体外传代培养后,其核苷酸序列可能有少量变异,但各株间衣壳蛋白(VP)氨基酸的一致性仍达98%~100%。
由于HAV只有单一的抗原特异性,病毒交叉中和试验未发现HAV株间有差异,故早期与甲肝病人接触者,使用免疫球蛋白能预防HAV感染有其理论基础。此外,根据HAV仅有单一的中和位点,则可采用中和位点相应的合成肽或重组DNA媒介体生产病毒抗原,制备甲肝基因工程疫苗,在某些国家已获得成功。
乙型肝炎病毒(HBV)是一个42nm有外壳(HBsAg)和核心(HBcAg)组成的DNA病毒,HBV的核心由DNA、DNA多聚酶、HBcAg和HBeAg组成。病毒颗粒的表面成分均以球状(直径约为22nm)和管状(直径约22nm,长约230nm)形态存在,是主要的外壳蛋白成分,称之为乙型肝炎病毒表面抗原(HBsAg),见图1。乙型肝炎基因组外侧为负股,含约3200个核苷酸,该股上有4个开放编码区,即外壳蛋白编码区,核心蛋白编码区、聚合酶编码区。X蛋白编码区外壳蛋白编码区含Gene S,pre-S1,pre-S2,egne-S编码主要蛋白,即HBsAg,pre-S 1召与pre-S2及Gene-S三者一起编码大蛋白(含表面抗原及前S1前S 2蛋白),pre-S1单独则可编码前S1蛋白,pre-S2单独可编码前S 2蛋白,并可与Gene-S一起编码中蛋白(含表面抗原及前S2蛋白)。表面抗原、中蛋白及大蛋白共同组成该病毒外壳。血清前S 1及前S2蛋白出现较早,是传染性的标志。核心蛋白编码区(含Gene C、pre-C),Gene C与pre C共同编码312个氨基酸的多肽P25,后者在切去前C蛋白等后,即形成e抗原(P15-18)。若pre-C发生变异,则不能编码P25,血中e抗原转阴,故e抗原阴转,不一定表示复制中止。Gene C 可编码一段未经处理的核心多肽,然后装配成HBcAg颗粒。HBV复制时HBcAg表达于肝细胞内,血清中检测不到游离的HBcAg。但其特异性抗体即抗HBc-IgM可阳性,间接表示HBV复制。
HBV复制时,肝细胞和血清中可出现HBV-DNA(脱氧核糖核酸酶)。血清中测出游离型HBV-DNA表明传染性强的标志,慢性乙型肝炎患者在肝细胞内若在HBV-DNA整合,是诱导肝细胞癌变的原因之一。
HBV基因的P区,即DNA多聚酶编码区,该区全长2496bp,编码含832个氨基酸的多肽,此酶为HBV-DNA生物合成所必需,HBV复制时,DNA多聚酶在血清中活力升高,表示有传染性,但该酶特异性不强,在其它DNA核酸类型的病毒复制时,DNA多聚酶活力亦可升高。
HBV的X基因,全长462bp,编码含154个氨基酸多肽,称为乙型肝炎X抗原,血清HBxAg阳性亦提示HBV复制和有传染性的标志,它可激活肝细胞基因组内的原癌基因(oncogene),与原发性肝癌的发生有一定关系。
HBV的复制与共价闭合环状DNA(CCC DNA)分子的形成、HBV-DNA负股形成和正股合成均有密切关系(图1)。在动物实验中,证实克隆时CCC DNA在不含有其它病毒的情况下,可合成前基因组RNA的复制周期。如在鸭HBV感染时,CCC DNA为先于病毒正链、负链而首先出现的病毒DNA,这些结果证实CCC DNA可作为模板合成前基因组的RNA和mRNA。
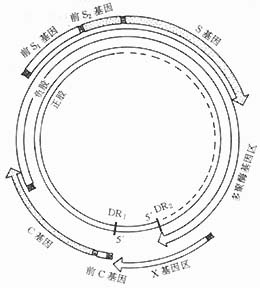
图1 HBV基因组结构(黑方块标记为各基因起始点)
受染肝细胞质内HBV复制成熟过程主要依靠成熟病毒颗的分泌和CCC DNA在受染肝细胞中的自我放大,这样才能使受染肝细胞中HBV长期稳定的存在。
丙型肝炎病毒(HCV)可通过血行传播,1989年美国Choo等从感染的黑猩猩血液标本中,在100万个克隆中,仅找到了一个阳性克隆,当时命名为丙型肝炎病毒。HCV是一个有外壳,大小为30~80nm的单股正链RNA病毒,在肝细胞内能复制,经1∶1000福尔马林37℃小时处理,加热100℃分钟或60℃小时,其传染性消失。至今HCV基因结构已明确,根据分离的大量HCV基因株确定其全部分子为9416碱基对,核衣壳和包膜蛋白由基因组的5'末端编码组成,HCV的核心区较保守,外壳编码区较易发生变异。国外学者根据HCV基因株作了核苷酸的序列分析,Weiner等从丙型肝炎病人中分出6株HCV的基因组,其中至少有4个是世界上公认的主要的基因型。Ⅰ型为美国、欧洲的主要类型,即HCJⅠ型,Ⅱ型为HCJ、BK、HcJ 4,是日本的主要类型,Ⅲ型为HCJ6,Ⅳ型为HCJ7。我国大多丙型肝炎病人血清的HCV基因属Ⅱ型。例如上海地区对33例慢性丙型肝炎血清HCV RNA基因分型,其中Ⅱ型占22例(66.6%)。对HCV基因序列分析为制备早期诊断HCV的试剂提供了理论根据。在E1和E 2/NS1区内有突变区,这些区在病毒外膜蛋白上是重要的抗原位点。该区域的变异性在诊断筛选、免疫预防、HCV的持续感染等方面有参考意义。
HCV在体外培养已获得成功,经正常黑猩猩接种HCV后15天,在其血清中即能检出HCV-RNA,持续阳性时间达3周左右。在HCV接种后2天,肝内亦可检测到HCV RNA,抗HCV在接种后3~8个月呈阳性。
丁型肝炎病毒(HDV)为一种缺陷性RNA病毒,直径为35~37nm,具有HBsAg的外壳,分子量为68000。HDV能导致病情加重和感染的慢性化,并可能与原发性肝癌(HCC)的发生有关。近期利用血清斑点杂交和原位杂交等技术,除观察到HDV-RNA的消长和HDAg、抗HD-IgM的消长规律一致并与肝细胞损害平行外,还有一些新的发现。如过去认为抗-HD产生后不再能检出HDAg,表示病毒复制静止;合并HDV感染后将抑制嗜肝DNA病毒的复制与表达,但可使乙型肝炎病情加重,或导致暴发性肝炎、慢性活动性肝炎及肝硬化等。通过分子杂交观察表明,在抗-HD-IgG产生后,约有60%的患者血中仍有低水平的HDV RNA,提示病毒仍在复制;但亦发现HDV感染的无症状携带者,无明显肝组织的损害。1989年罗世垣等报道,在70例HBV复制标志阳性组中,肝内HDAg均阴性,而HBV复制标志阴性的37例肝内HDAg阳性者计2例(5.4%),与文献报道HDV感染对HBV复制与表达有抑制作用似相符。
HDV的复制尚不明了,有人推测HDV的复制可能与植物病理相似,可以通过双旋转周期模式(rolling circle)复制其RNA。
在HBV感染的黑猩猩动物实验中,接种HDV后3周,其肝内发现HDAg,第4周后血清中出现HDAg,第9周血清中抗HD呈阳性。多次接种HDA可见发病潜伏期进行性缩短,病情严重,易形成慢性肝炎,肝脏病变亦进行性发展,感染HDV的黑猩猩可在数月至数年内死亡。此外,文献报道用免疫组化法在土拨鼠实验性感染HDV后,肝细胞核及细胞质内可找到HDAg,肝细胞亦出现典型的肝炎病变。血清中HDAg在HDV接种后1~5周出现。以上结果证明,HDV的感染易发展为慢性肝炎,与人体HBV慢性感染者合并HDV感染易变成慢性化的临床和肝脏病理经过是相符合。
HDV感染在HBV携带人群中的传播可造成病情的进展,加重及恶化等严重后果。因此,防治HDV的感染在肝炎防治中有其重要意义。
戊型肝炎病毒(HEV)是肠道传播肝炎的新病原,过去称为肠道传播的非甲非乙型肝炎病毒(ET-NAN-BV)。在病人粪便中可发现病毒颗粒,其直径29~38nm,为圆形颗粒,表面有圆形突起和缺口,无外壳,属单股、正链的RNA病毒,沉降系数为183S,浮密度为1.29g/cm 2。其核酸靶序列对R Nase敏感而对D Nase稳定,病毒抗体复合物在4℃很易变性,对pH改变不敏感。
HEV基因组的核苷酸链长度约为7500个碱基,3'末端具有Poly A结构,含有150~200个腺苷;5'末端含有27个碱基的非编码区,其中含有开读框架(ORF)三个(即ORF1、ORF 2、ORF3),开读框架的功能主要编码非结构蛋白、中和RNA的负电荷及识别HEV感染人及动物时的多肽免疫反应。但目前对HEV的免疫学反应知之甚少,有待进一步深入研究。
以上阐述五种(甲、乙、丙、丁、戊型肝炎病毒)病毒性肝炎的病原学特性,但引起病毒性肝炎的其它型别的病原,如近期美国报道的GB型病毒性肝炎,日本的X型病毒性肝炎均属第7种新发现或尚待公认的新型毒株。我国北京最近发现第7种病毒性肝炎即庚型病毒性肝炎,其病原学特性与临床特征等,均有待广大医学科研工作者进一步深入研究。
【发病机理】
病毒性肝炎的发病机理颇为复杂。过去认为HAV对肝细胞有直接杀伤作用,很少通过免疫机理引起肝细胞病变;但近期文献报道HAV侵入人体后,感染初期为原发的非细胞病变阶段,此时HAV在肝细胞内大量复制和释放;至疾病恢复期,病毒产生减少,肝细胞内可见汇管区有大量单核细胞浸润,并伴肝细胞轻度坏死和小叶中淤胆,在肝外组织如腹腔内淋巴结、脾脏和肾脏中可检出HAV,在肾小球血管基底膜上有免疫复合物沉积,以上现象提示甲型肝炎的发病可能有免疫病理参与。HBV感染人体后,其所引起的肝脏和其他脏器病变,以及疾病的发生、发展,并非病毒本身所致,而是与人体的免疫状态有一定的关系。HBV进入人体后,侵袭肝细胞,在其中复制繁殖,然后从肝细胞中逸出,并不引起肝细胞的损害,但在肝细胞膜表面上形成特异性的病毒抗原。从肝细胞逸出的病毒进入血循环后,可刺激免疫系统(T淋巴细胞和B淋巴细胞),产生致敏淋巴细胞(细胞免疫)和特异性抗体(体液免疫)。进入血液循环的病毒被具有免疫活性的T淋巴细胞识别,后者致敏增生。此种致敏淋巴细胞与肝细胞膜表面上的病毒抗原相结合,使致敏淋巴细胞释放出各种体液因子,如淋巴毒素、细胞毒因子、趋化因子、移动抑制因子、转移因子等,结果将病毒杀灭,肝细胞亦遭受损害,引起坏死和炎症反应。免疫反应强烈的患者可能发生急性重症肝炎(暴发性肝炎),细胞免疫功能低下者,感染HBV后易演变为慢性肝炎或携带者;免疫功能正常且侵及肝细胞的病毒量较多时,临床表现多为一般的急性黄疸型肝炎。导致慢性持续HBV感染的机制,可能包括病毒和宿主两方面的因素。近期资料表明,慢性HBV感染者的肝细胞基因组有HBV-DNA整合,病程越长,整合的机会越多,肝细胞内HBV-DNA的整合与原发性肝细胞癌的发生有密切关系。HBV致病过程必须有宿主免疫细胞或抗体参与。特异性细胞免疫反应是引起乙型肝炎慢性化的重要原因之一,其中细胞毒性T细胞(Tc)在清除肝细胞内HBV中起着主要作用,Tc能识别表面附有病毒抗原的肝细胞,在巨噬细胞协同下,攻击肝细胞使其破坏,同时杀灭肝细胞破坏时释放的HBV。宿主细胞免疫功能低下或缺陷时,Tc功能亦低下,致使不能消灭和清除肝细胞内的HBV。Tc清除细胞内HBV的效率不仅取决于肝细胞表面病毒抗原的表达,同时也有赖于HLA(组织相容抗原)的密度。肝细胞表面HLA表达的减少可能是Tc不能有效地清除细胞内肝炎病毒抗原机制之一。自然杀伤细胞(NK)和干扰素在抗病毒机制中具有相当重要作用,慢性乙型肝炎患者的NK活力每低于正常,其干扰素产量亦低下。干扰素活力低下可能与HBV感染慢性化有关。
抗病毒抗体对终止HBV感染具有十分重要的作用。在慢性HBV感染时,体内抗-HBs产生减少,因此不能中和循环内的HBV,亦不能阻止HBV感染健康肝细胞。抗-Dane颗粒(完整HBV)的抗体对于清除HBV似更为重要。在慢性HBV感染时,血清中抗-Dane颗粒抗体亦减少。
慢性乙型肝炎的肝细胞损害和炎症反应是由于免疫细胞作用于肝细胞的结果,以Tc破坏受染肝细胞的作用最为重要。肝组织内的淋巴细胞直接攻击肝细胞等亦引起炎性病变。Don等的体外实验发现;淋巴细胞特别是T淋巴细胞和K细胞(杀伤细胞)侵入肝细胞,前者可释放淋巴毒,后者起杀伤作用,使肝细胞发生碎屑状坏死等。本院曾对52例慢性活动性肝炎患者作肝穿刺病理检查,结果有2例在电镜下见到淋巴细胞侵入肝细胞内的现象,该2例的肝细胞病理检查可见较明显的碎屑状坏死,临床病情活动,ALT持续和反复升高达数月,经3年随访该2例均发展为肝炎后肝硬化。
慢性活动性肝炎(慢活肝)的发病亦与细胞膜成分的自身免疫反应有关,主要表现为抗肝细胞膜成分抗体的出现,这些抗体可能对肝细胞有直接损伤作用,亦可介导抗体依赖性淋巴细胞毒(ADCC)导致肝细胞损伤。慢活肝患者的肝细胞膜表面存在两种特异性抗原,即LSP(肝细胞膜特异性脂蛋白)和LMA(肝细胞膜抗原),在患者血清中存在相应的抗-LSP和抗-LMA。由于抗-LSP经循环进入肝小叶时,首先集中在小叶周围区,通过ADCC的作用造成肝小叶周围区碎屑状坏死。
慢活肝患者血清免疫球蛋白可明显增高,Prys等通过对比观察,发现病毒性肝炎患者血清IgG升高者常提示肝内病变活动,并有较显著的肝细胞坏死。IgA升高者肝内纤维化程度显著;而IgG、IgA和IgM同时升高,常提示肝小叶结构破坏及纤维化程度严重。我院对慢性肝炎患者作血清IgE测定,发现慢活肝患者血清IgE可明显增高,血清IgE活力高低与ALT活力变化大多呈平行关系;与肝脏病变轻重亦有一定关系,71例血清IgE活力升高者,68例同时伴ALT活力上升,占95.3%。而血清IgE活力正常的24例中,ALT活力正常者计21例,占87.5%。血清IgE活力升高者,其肝细胞点状坏死和碎屑状坏死的病变较多且较严重。一般认为免疫球蛋白升高是由于枯否细胞吞噬抗原的功能降低,使抗原溢出到抗体生成部位(如脾脏等),以致形成大量的自身抗体。Thorn等报道特异性抗原与固定于组织的IgE相互作用,通过一系列化学介质(如组胺、前列腺素等)的作用,可使细胞内CAMP水平下降,造成细胞病变,此时肥大细胞被激活,可使组织内IgE释放,从而使血清中IgE活力升高。认为在慢活肝患者中由于Ts细胞功能低下,因而IgE合成亢进,后者导致肝内肥大细胞释放组胺等生物活性物质,可能参与慢活肝病变的形成。
近期应用T细胞亚群单克隆抗体 (CD系列McAb技术)对慢性肝炎肝组织炎症反应中T细胞亚群组分的研究表明,CD4的辅助性T细胞百分率低下,CD8的抑制性/细胞毒性T细胞(Ts/Tc)百分率增高,因而CD4/CD8比率显著下降。还证实患者抑制性T细胞在功能和表型上不一致,即抑制性T细胞功能低下而CD8的抑制性T细胞百分率增高。其免疫调节功能紊乱,至少包括两类抑制细胞功能低下,并和病情有关。本校病理教研室以McAb、ABC法对79例各类肝病组织内浸润的单核细胞作原位分型,发现慢性活动性肝炎单核细胞多,其中大多为T细胞,而CD8与肝细胞坏死关系密切,提示慢性肝炎实质损害与CD8细胞直接有关。
乙型肝炎的肝外表现与其相应循环免疫复合物(CIC)的关系已得到公认,但免疫复合物在肝损害中的作用至今尚有争论。文献报道各种肝炎和肝硬化尸检病例108例,发现58.1%病例在肝和肝外组织内有HBV抗原(HBVAg)和/或HBsAg免疫复合物存在。病理检查结果提示肝脏损害程度与肝内HBsAg免疫复合物的含量成正比。Ray等证实病毒性肝炎患者的肝细胞内除HBsAg及其抗体的免疫复合物外,还存在HBcAg及其抗体的免疫复合物,但认为后者不一定引起肝损伤。
最近文献报道,在肝炎病人血清和肝组织内检出多种具有调节免疫作用的物质,包括花环形成抑制因子(RIF)、极低密度脂蛋白(VLDL)、肝性免疫调节蛋白(LIP)、血清抑制因子(SIF)及白细胞介素-Ⅱ(IL-Ⅱ)等。上述免疫调节物质的功能失调可导致肝细胞破坏,反之,则能减轻肝细胞的损害。总之,乙型肝炎的发病机理和免疫反应相互交织,错综复杂,目前绝大多数学者认为HBV本身不能单独引起病理变化,其致病过程必须有宿主免疫反应参与。
【病理改变】
各型病毒性肝炎的病理变化,按病变轻重以及病程经过,可分为急性、慢性和重症肝炎3大类。
(一)急性肝炎 肝脏大多肿大,表面光滑。镜检有以下几种变化。
1.活动期 肝细胞混浊肿胀,有水肿样变和气球样变,小叶内有炎症细胞浸润,以淋巴细胞为主,并见散在点状坏死,枯否细胞增生明显。黄疸型肝炎的肝细胞和毛细胆管内有淤胆现象,亦可见嗜酸性变,严重者细胞缩小甚至丧失,成为红染圆形小体,即嗜酸性小体。上述活动性病变可存在数月之久。
2.静止期 肝细胞的灶性坏死、变性和炎症反应消退,并见肝细胞再生和修复,表现为细胞核分裂或双核现象增多。枯否细胞仍肿胀。
急性无黄疸型肝炎与黄疸型肝炎的病变大致相同,但较轻,无毛细血管淤胆现象。
(二)慢性肝炎 患者肝脏大多较正常为大,质地中等,慢性活动性肝炎有时可呈颗粒状或有结节形成。
国内将慢性肝炎的组织学变化分为四型,即慢性迁延性肝炎、慢性活动性肝炎、慢性重症肝炎及肝硬化。
1.慢性迁延性肝炎 分以下3类:
⑴慢性小叶性肝炎:主要变化为肝小叶内炎症和肝细胞变性及坏死,汇管区的改变不明显。单从形态上无法与急性轻型肝炎区别,系急性轻型肝炎病变的持续未缓解所致。
⑵慢性间隔性肝炎:小叶内炎症反应及变性坏死轻微,汇管区纤维细胞向小叶内伸展形成间隔,间隔内炎症细胞很少,不形成假小叶。
⑶慢性门脉性肝炎:肝实质变性及坏死病变较轻,有少数点状坏死,偶有嗜酸性小体,汇管区有多量炎症细胞浸润,致使汇管区增大,但并无界板破坏或碎屑状坏死。
2.慢性活动性肝炎 碎屑状坏死为主要特征,小叶内病变包括点状和(或)灶性坏死、甚至灶性融合性坏死,以及变性和炎症反应。有桥形坏死及间隔形成者,提示病变较重。
3.慢性重型肝炎 实质上包括重型慢性活动性肝炎,即肝细胞坏死范围更广泛,可累及多数小叶并破坏小叶完整性,或呈具有高度活动性的肝硬化。
4.肝硬化 分活动性和静止性两种。
⑴活动性肝硬化:肝硬化同时伴有碎屑状坏死,后者见于汇管区周围及纤维间隔和肝实质交界处,肝细胞有变性坏死及炎症反应。
⑵静止性肝硬化:假小叶周围纤维间隔内炎症细胞很少、间质和实质界限清楚。
(三)重症肝炎 肝实质破坏严重,呈大块或亚大块坯 煞费苦心,按病程和病变程度分为急性和亚急性两型。
1.急性重症肝炎 起病急,病程短,大多在10天左右。由于肝细胞大量丧失和自溶,肝脏体积明显缩小,仅为正常肝重的1/3~2/3,质地柔软,包膜皱缩。肝切面结构模糊,红褐相间,乃由肝细胞淤胆和血窦扩张充血所致。镜下可见肝细胞多数消失,仅在小叶边缘尚有少量残余,肝小叶内有单核细胞和淋巴细胞浸润。肝窦扩张充血,枯否细胞增生,其内含有被吞噬的物质和色素,汇管区及其周围有多量淋巴细胞浸润及胆小管增生。病程在10天以上者,可见肝细胞再生和形成,病程超过20天者,肝细胞再生明显,可形成小结节。
2.亚急性急症肝炎 病程自数周至数月不等。肉眼所见病变与急性重症肝炎者相同,但在肝脏表面和切面均可见到再生结节。镜下见有亚大块死,多呈带状,累及小叶中央及中间带,并常越过小叶与邻近小叶的坏死灶或汇管区相连,形成桥形坏死。肝细胞坏死的范围和形态新旧不一,网状支架塌陷明显,形成较宽的间隔,并有纤维母细胞增生,有的已胶原化。肝细胞内炎性细胞浸润明显,以淋巴细胞、大单核细胞为主。肝细胞再生明显,有假小叶形成,病情稳定后亦易发展为慢性肝炎或肝硬化。
丙型肝炎的组织病理变化大致与乙型肝炎相同,但以下病变在丙型肝炎中较为突出:①肝细胞脂肪变性较多见;②肝细胞坏死常表现为多少不等的呈小灶性分布断裂的Conncilman样小体结构。在电镜下证实肝细胞核内有20~27nm的病毒颗粒;③汇管区炎症反应明显,其中有多量淋巴细胞和浆细胞浸润,并常有淋巴滤泡形成,其中尚有活跃的发生中心。炎症常波及汇管区周围小叶周边区肝细胞,引起碎屑样坏死,在坏死边缘往往可见肿胀变性的多核肝细胞;④肝管上皮细胞异常,表现为中、小胆管上皮细胞水样变性,并呈复层排列,周围有淋巴细胞和浆细胞浸润。
【流行病学】
(一)传染源 甲型肝炎的主要传染源是急性病人和亚临床感染者,在甲型肝炎自然史中,亚临床型或隐性感染是主要的。甲型肝炎暴发流行时,隐性感染与显性感染的比例最高为10∶1。甲型肝炎患者自潜伏末期至发病后10天传染性最大,出现黄疸后20天始无传染性。实验资料表明甲型肝炎病人从粪便中排出HAV的时间不长,以潜伏期末和发病初期排出病毒浓度最高,病后第三周已很少在粪便中检出,故甲型肝炎病人在恢复期无传染性,在流行病学有意义的系甲型肝炎亚临床型或隐性感染患者。
急性和慢性乙型肝炎患者以及病毒携带者均是病毒性肝炎的传染源,急性患者从潜伏期末至发病后66~144天,其血液内都具有传染性。由于传染期短,作为传染源的意义不如慢性肝炎患者和病毒携带者大。根据各国人群中乙型肝炎的检测结果,估计全世界约有2.15亿乙型肝炎病毒携带者,构成了重要传染源。慢性患者在病情活动期亦有传染性,国内对811例慢性肝炎病人作了家庭调查,同时以811例健康人家庭作为对照,结果发现病毒性肝炎的接触者中肝炎续发率为2.68%,而对照组肝炎续发率为1.09%。乙型肝炎有家庭聚集趋势,其HBV总感染率可达62.5%(包括HBsAg、抗HBs、HBeAg、抗-HBe及抗-HBc阳性者),明显高于人群中HBsAg阳性检出率(10%~15%)。父母HBsAg阳性或母亲HBsAg阳性的家庭中HBV感染率可达87.5%,慢性活动性肝炎和肝炎后肝硬化患者的子女,HBV感染率分别为91.7%和66.7%,HBsAg携带者的子女HBV感染率为14.2%。HBsAg阳性的慢性患者和无症状携带者,其传染性取决于HBeAg是否阳性,HBeAg阳性者传染性强。
丙型肝炎分布世界各地,无明确地理界限,在西欧、美洲人群中HCV的感染率约0.3%~1.5%,中东地区为5%左右,中国某市对献血员中检测抗HCV,阳性率为7.9%(22/279)。HCV感染率最高的危险人群以接受输血者为甚。故慢性丙型肝炎和HCV或抗HCV阳性无症状携带者均是病毒性肝炎传染源。
(二)传播途径 甲型肝炎病毒主要从肠道排出,通过日常生活接触而经口传染。病毒性肝炎多呈散发性,集体单位如不注意病人的隔离、食具消毒,宿舍、厕所等的卫生,以及在流行地区未抓好食品检验工作和对饮食、摊贩人员的卫生监督等措施,则有发生病毒性肝炎大小不等流行的可能。甲型肝炎常引起爆发流行,主要通过水或食物的污染而引起,农村中多见井水污染而引起的小型爆发,发病与饮用生井水或河水有关。由食物引起甲型肝炎爆发流行已屡见不鲜,常因处于潜伏期排毒的炊事员,经手接触污染熟食所致。生食受HAV污染的贝类引起甲型肝炎爆发国外已有不少报道,例如1983年英国东南部19个地区发生甲型肝炎流行,通过450例病毒性肝炎患者调查,42.6%患者发病前有吃乌蛤史,而对照仅17.5%。国内1978年宁波市因食泥蚶引起2000多人的爆发。上海市1983年也曾因毛蚶产地污染引起甲型肝炎的流行;该市1988年初发生甲型肝炎大流行系由生食毛蚶所造成平均罹患率为4082.6/10万。根据抽样调查,居民中的食蚶率为32.1%,食毛蚶者甲型肝炎罹患率达14%~16%。吃蚶人群甲型肝炎罹患率比未吃蚶人群者的相对危险性高23~25倍,特异危险度为11.5~15.2。我校流行病教研室首先用核酸杂交、组织培养法直接从毛蚶体内分离到甲肝病毒(HAV),后又用多聚酶链反应(PCR)技术证实毛蚶中有HAV存在。再次证实该次甲型肝炎爆发流行是食不洁毛蚶引起。
乙型肝炎病毒(HBV)可通过输血、血浆、血制品或使用污染病毒的注射器针头、针灸用针、采血用具而发生感染,血液透析等亦有感染HBV的危险。一组调查报告中表明,半年内有注射史的6950人中,HBsAg阳性率为4.65%,同期内无注射史的10953人中,HBsAg阳性率为3.99%,两者在统计学上有显著差异。关于经口感染问题,有人认为病毒入口后必须通过消化道粘膜破溃面,如口腔溃疡、胃和十二指肠溃疡、食管炎等病灶进入血行而发生感染。在消化道功能正常的情况下,经口感染乙型肝炎的机会远较甲型肝炎为低。国外在人的实验性感染中,给于45名“志愿者”口服乙型肝炎患者的粪便悬液,结果均未发病。流行病学调查也表明在接触粪便机会较多的清洁工人中HBsAg及抗-HBs的阳性率并不比对照组清洁工或其他人群高。此外,各种体液在传播乙型肝炎中的作用应予重视,业已证明HBsAg除存在于血清外,还可在唾液、尿液、胆汁、乳汁、汗液、羊水、月经、精液、阴道分泌物、胸腹水等中检得。其中唾液在传播中尤具重要意义,在急、慢性乙型肝炎患者或HBsAg携带者唾液中25%~50%可检出HBsAg。鉴于乙型肝炎主要由接触病人或HBsAg携带者的血液和分泌物所引起,故医务人员亦易从病员中感染乙型肝炎,其中以口腔科和外科医生感染HBV机会较多。例如国外有一名牙科医生,其血清中HBsAg和HBeAg均阳性,电镜检查证实血清中有Dane颗粒。4年内经其治疗的患者中有11例发生乙型肝炎,其中9例的HBV亚型和牙科医生的亚型相同。该医生经常不戴手套进行操作,且手经常有破损史,HBV系由血经口感染。
乙型肝炎的母婴传播主要系分娩时接触母血或羊水和产后密切接触引起;但少数(约5%)可在子宫内直接感染。HBeAg阳性孕妇行引产或流产所获得的胎儿肝组织中曾找到HBeAg,说明病毒性肝炎可通过胎盘直接传播。母血HBeAg阳性者婴儿的感染率达90%以上,母血HBsAg阳性而HBeAg阳性者,婴儿HBV感染率较低(27%~30%)。我国台湾省及日本国报HBsAg母婴传播率为36.6%~40%。孕妇在妊娠前期(1~6月)感染乙型肝炎,产后10%婴儿HBsAg呈阳性;妊娠末期(7~9月)感染病毒性肝炎者,76%婴儿的HBsAg为阳性。
丙型肝炎主要通过输血而引起,病毒性肝炎约占输血后肝炎70%以上。在大多数发达国家,丙型肝炎是输血后肝炎最常见的一种类型,80年代(在欧洲)的前瞻性调查表明,在多次接受志愿献血员的血液者中,有6%~12%发生输血后肝炎。国外报道1,664例受血者中,发生输血后肝炎246例(14.8%),其中丙型肝炎达237例(96.3%)。在肾移植病人中大多数急性和慢性肝炎的发作可能是由丙型肝炎所致。
随着免疫诊断试剂(抗HCV、HCV-RNA-PCR法)的应用,输血后HCV感染率大大降低,如在美国,感染率从以前的3.84%降到0.45%。反之,对血液或血制品检测不严,可造成丙型肝炎暴发流行。例如中国某地曾因单采血浆回输血细胞时污染,造成病毒性肝炎流行,经2年以上随访,被输血者血清抗HCV阳性率达100%。
HCV的传播经血行感染的事实已被证实,但散发的HCV感染者约40%~50%无输血或用血制品史,并确切传播途径尚不明确,但有报道各种体液;包括腹水、胸水、精液、尿及阴道分泌物等可由双扩增PCR技术检测到HCA。此外,同性恋以及家庭或集体生活环境中有长期接触丙型肝炎病人或HCV携带者的人群中,HCV感染危险性则更大,故密切接触而传播病毒性肝炎的方式亦应引起重视。有关母婴传播HCV业已证实,例如在25名抗HCV阳性母亲所生的婴儿,于出生后2~4个月有14名抗-HCV阳性母亲所生的婴儿,于出生后2~4个月有14名抗-HCV消失,但出生后6~12月,其中11例婴儿抗-HCV阳转,并发生丙型肝炎。
HDV的传播方式与HBV相同,急、慢性丁型肝炎病人和HDV和HBV携带者为病毒性肝炎传染源,HDV感染分布呈不均匀性,意大利报告在HBsAg携带者中HDV感染率高达50%左右,而在德国和美国仅分别为1.9%和0.39%。我国HDV感染率各地报告不同,北京抗-HD阳性率2%(5/244例),但在肝组织中HDV检出阳性率在亚急性重症肝炎为4.76%(2/42)、慢性活动性肝炎为5.78%(7/121)、慢性迁延性肝炎为5.0%(2/40),而9例HBsAg携带者肝组织中HDV均为阳性。
母婴传播HDV,仅见于HBeAg阳性和抗-HD阳性母亲所生的婴儿,大多感染HDV的婴儿在围产期。
戊型肝炎的传染源主要是患者粪便污染水源或食物,传染途径主要通过粪-口感染。根据流行情况分为两种类型,一为短期流行,即水源被一次性污染,流行数周;二为长期流行,即水源持续性被污染所致,流行期可达数月之久。经食物传播或日常生活接触得病者常呈局部流行和有明显家庭聚集性流行。
病毒性肝炎流行与社会经济、卫生习惯和文化素质等密切有关,亚洲、非洲及中美洲均有病毒性肝炎暴发性流行,英、美、法及俄罗斯有散发病例发生
英文名称:
VH;viral hepatitis;virus hepatitis
患病部位:
腹部疾病*
一级分类:
感染与传染病学*
二级分类:
肠道传染病*